機能性表示食品の措置期間終了まであと7か月!対応はお済ですか?
2025年4月の制度改正から間もなく1年。
PRISMA2020への完全準拠や新様式への対応など、実務への定着が進む中、
2026年は対応期限が集中する重要な年となります。
3月末の「初回自己点検報告」に始まり、
他にも重要な対応期限が控えています。
そこで今回は、複数の期限を前に、
事業者が優先的に取り組むべき実務のポイントをわかりやすく解説します。
┏━━━━━━━━━━━━……‥‥・・・
◆2026年、必ず対応すべき3つのこと◆
┗━━━━━━━━━━━━……‥‥・・・
今年行うべき対応は主に以下の3つです.
対応① 初回自己点検報告:期限2026年3月31日
対応② GMP完全義務化:施行2026年9月1日
対応③ 表示見本新ルール対応:2026年9月1日製造分から
【対応①:自己点検報告】
対象商品:2025年3月31日時点で届出番号を有する全ての機能性表示食品
※販売中止製品も対象に含まれます。
実施内容:
自己点検報告では、以下の項目を確認し、消費者庁の届出データベースに
チェックリスト(様式Ⅶ)と試験成績書(非公開)を提出します。
・安全性および機能性の根拠について、報告期間中に新知見がないか
・生産・製造および品質管理の運用状況
・関与成分の分析結果(報告期間中の実施状況)
・健康被害情報の収集体制と報告実績
・その他の届出事項全般が最新情報に更新されているか
重要なポイント:
この報告がない場合、機能性表示食品としての要件を欠くことになりますので、
3月31日の期限厳守が不可欠です。
【対応②:GMP遵守完全義務化】
対象商品:「天然抽出物等を原材料とする錠剤、カプセル剤、粉末剤、液剤等」の形状の加工食品。
理由:精製・濃縮された特定成分を含む食品は、
通常の食品に比べて過剰摂取による健康被害が発生するリスクが高いため、
原材料の受入れから最終製品の出荷まで、
一定の品質を保つ厳格な製造工程管理(GMP)が遵守事項として義務付けられました。
実施内容:
対象商品について、変更届を提出します。
様式Ⅲの「製造及び品質管理基準(GMP告示)」の遵守状況について、
チェックボックスにチェックを入れ、管理体制を記載してください。
管理状況の詳細を記載して変更届を提出します。
スケジュール上の注意:
9月1日から完全義務化されるため、8月末までに変更届が承認される必要があります。
早めの提出をお勧めします。
【対応③:表示見本(パッケージ)の切り替え(〜9/1)】
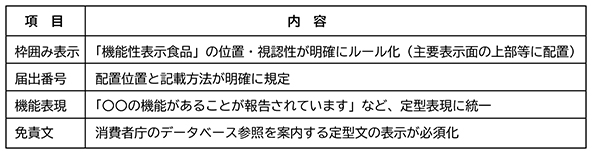
実施内容:
・新ルールに対応した表示見本(様式Ⅳ)を作成します。
・変更届を提出します。
・パッケージデザインを修正し、印刷・発注を進めます。
具体的にどんなことをすればよいかわからない。
状況を整理して助けてほしい!という方もご安心下さい。
EBF事業推進室では、お客様の状況を丁寧にヒアリングし、
総合的にサポートすることが可能です。
特に複数の期限対応が重なる2026年だからこそ、早期のご相談をお勧めします。
お問合せはこちらから
https://bhn.co.jp/contact-ebf/
